デジタル医療の開発とブロックチェーンの医療応用
1.背景
1.1 医療における疾病構造の変化とデジタル医療
超高齢社会を迎えた日本において,GDPに占める社会保障費の増加は,将来の医療を脅かす課題となっている.限られた生産年齢人口で高齢者を支えつつ医療水準を保つためには,医療資源による業務効率の向上とマンパワーに依存しない医療の実現が不可欠となる.
これまで医療が目指す健康は,世界保健機関の定義である「心身及び社会的に安寧な状態を意味し,単に病気や虚弱でないということではない」とされ,急性疾患を主な対象疾患としていた70年前に策定された定義を引き継いでいる.その後,人口構造や社会環境,疾病構造が変化する中で,健康の再定義の必要性が議論されている.現代の医療システムにおける対象疾患の大半は慢性疾患であり,システムの持続可能性に大きな影を落としている.これら現状を鑑み,慢性疾患などの状態を単に不健康と見なす既存の定義ではなく,より現代の社会システムに即したものとして,「健康とは,社会的・身体的・情緒的困難に適応し,自己管理する能力を有すること」という新たな定義も提唱されている[1].
生活習慣病を始めとする慢性疾患では,行動変容による治療効果が期待され,既存の医薬品の投与による治療に併用/代替するものとして,情報処理技術,ネットワーク技術を活用したデジタル医療が開発されている[2].本国においても,2014年の薬機法(医薬品,医療機器等の品質,有効性および安全性の確保等に関する法律)改正により,診断・治療等に用いるソフトウェア単体が医療機器として定義され,開発が進められている.WellDoc社の糖尿病治療用アプリBlue Starは,既存療法に併用することによりHbA1cの低減効果が示され,2010年には米国における医療品規制・食の安全を取り締まるFDA(Food and Drug Administration)による承認を得ている[3].また,単体で疾患治療を行うデジタル医療として,Pear Therapeutics社のreSETが薬物依存治療に有効として2017年にFDAにより承認された[4].これらデジタル医療はこれまでの医薬品による治療と異なり,ソフトウェアの使用を通じて生活習慣を変容させることによる治療効果を期待するものである.さらに,医薬品の処方では内服状況の把握が困難であるのに対して,デジタル医療では治療と同時に患者データが生み出される点が大きく異なる.具体的には,既存の糖尿病患者の治療においては,医師による食事療法・運動療法が治療行為として行われているが,デジタル医療ではこの治療行為をソフトウェアに入力された患者の血糖値等の情報を元にして,データに基づいた食事療法・運動療法が提供される.米国を中心としてデジタル医療の社会実装が進められ,デジタル医療の活用によって医療費削減効果もあることが試算されている.一方で,デジタル医療による治療効果の科学的根拠は,医薬品等のエビデンスと比較して未熟であり,現在,構築途上にある.近年,デジタルプラセボ効果の存在も指摘され,真の治療効果を検証するための試験デザインが求められている[5].
我々は慢性疾患である不眠障害に対する非薬物療法として,不眠障害を治療するモバイルソフトウェアの開発を2015年から開始し,規制当局の監督の下,薬機法による医療機器承認を目指した臨床試験ならびに治験を行っている.
1.2 医療費の増加と新規医療技術の開発
日本における医療費は年間42兆円を超え,GDPの8%に当たる[6].医療費の伸びは高齢化の進行とともに,高額な医薬品の普及など医療の高度化による影響が大きい.近年,社会保障費の抑制のために後発医薬品の活用が進められる一方で,新薬の開発コストは高騰し続けており,1剤あたりの開発コストが1970年代には1億7千9百万ドルだったのに対し,2000年以降では25億5千8百万ドルと14倍以上に膨れ上がっている[7,8].新薬の開発コストの高騰は,がん治療薬オプジーボで顕著に見られたような高額な薬価による社会保障費の増加を引き起こす.一方で,日本の新薬開発能力は世界第3位と高く,製薬産業の国際競争力の維持と経済活性化は重要課題である[9].
近年の新規医療技術は従来の低分子化合物ではなく,抗体医薬や核酸医薬,細胞治療といったバイオ医薬品が主となっており,ライセンスやM&Aの開発元はバイオベンチャーが圧倒的に多い.医療産業を活性化させるためには,開発パイプラインを多数有するベンチャー企業のエコシステムの構築が欠かせないが,臨床開発のコストがパイプラインの追加において大きな問題となる.
臨床開発を行う上で1998年の新GCP(Good Clinical Practice)施行以降,CRO(Contract Research Organization:医薬品開発受託機関)やSMO(Site Management Organization:治験施設支援機関)といった受託開発機関への委託費用が増加している.臨床試験においては,データの真正性が求められ,その不正は医薬品産業・医療への信頼を揺るがすものとなる.2012年に発覚したノバルティス社による臨床試験データ改ざんのディオバン事件[10]においては,製薬企業の関係者が臨床試験データの改ざんに関与し,その臨床試験データに基づいて臨床現場の医師による処方・治療が行われた.臨床試験・治験の依頼者である製薬企業・医療機器メーカーは臨床開発において利益相反の関係性にあり,CROやSMOといった受託開発機関による臨床試験・治験の運用が行われている.
一方で,臨床試験におけるデータの質と信頼性を担保するために,モニタリング業務の費用が増加し,原資料の直接閲覧による確認のための開発コストが大きくなっている.ディオバン事件を契機として,2018年度より臨床研究法が施行され,特定臨床研究実施時におけるモニタリングが義務化された[11].これにより臨床開発コストのさらなる増加が予想され,学術機関をはじめとする国内での臨床開発の遅れにつながることが懸念されている.
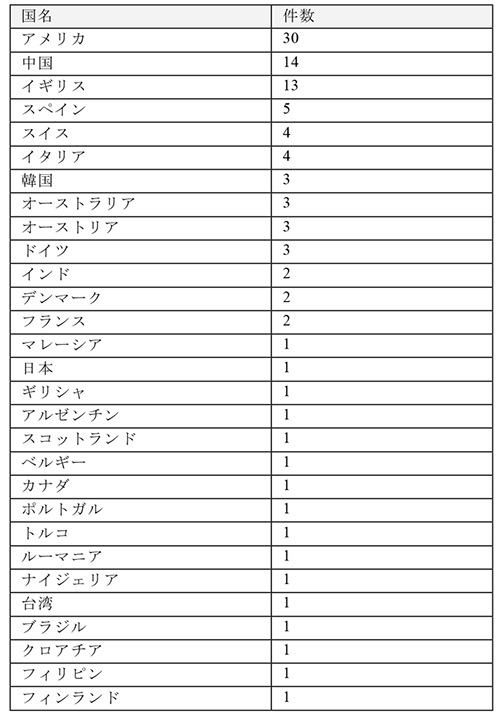
我々はデジタル医療の開発と並行して,本システムで取得・管理する医療データの信頼性担保を目的として,ブロックチェーン技術の医療応用に着手した.前述のようにデジタル医療では治療と同時に患者の医療データが生み出される.さらに,臨床試験・治験において,法規制上,データの真正性を証明することが求められることから,ブロックチェーン技術を用いてシステムにより担保することを試みた.ブロックチェーン技術の医療応用に関する医学論文は特に2018年以降急増している.米国国立医学図書館が提供する医学・生物学分野の学術文献検索サービスであるPubMed (https://www.ncbi.nlm.nih.gov/pubmed)でBlockchainをキーワードとして検索すると,2018年11月時点で84件の論文がヒットするが,うち60件は2018年に出版されたものである.筆者の国別の集計では,表1のようになっており,アメリカ,中国,欧州で活発に研究開発が行われていることが分かる.
2.不眠障害を対象としたデジタル医療の開発
不眠障害は日本人の約20%に認められ,さまざまな疾患に合併が認められる.不眠障害に対する治療としては,睡眠薬の安易な処方は是正することが求められており,非薬物療法が推奨されている.ベンゾジアゼピン系薬剤をはじめとする睡眠薬の多剤処方ならびに長期処方は,依存形成等の副作用の問題を引き起こすことが知られ,2017年には厚労省および独立行政法人医薬品医療機器総合機構から常用量依存に関する注意喚起の通知が出されている[12].2014年度から睡眠薬・抗不安薬に対する処方制限を目的として,診療報酬の減額処置が取られており,2018年度の診療報酬改定では長期処方も減額対象となった.一方で,睡眠薬の代替案となる非薬物療法は,医療現場におけるマンパワーの必要性と採算性から,十分に浸透しておらず,普及が遅れている.
上記の睡眠薬の適正使用,医療現場におけるマンパワーの問題を鑑み,不眠障害に対する適切な治療を実施するために,不眠障害を対象としたデジタル医療を開発し,臨床試験と治験を開始した.さらに,我々はデジタル医療におけるエビデンス構築を,医薬品と同レベルで実施するために,シャム(疑似)アプリを開発するとともに,本品/シャムを自動的に分岐させるためのシステムを構築し,さらに二重盲検で臨床試験を実施可能な管理システムを開発した.
3.デジタル医療におけるブロックチェーン技術の適用
我々が開発している不眠障害治療用のモバイルソフトウェアでは,患者本人が,医療機関などの特定の場所に依存することなく,スマートフォンなどのモバイル端末を通じて医療データを入力する.そのため,利益相反を有する第三者が介することなく,デジタル化された医療データを集積することが可能となる.これらの事項を鑑み,デジタル医療を事例としてブロックチェーン技術を応用することで,医療データの信頼性担保を実現する実証試験を行い,2017年に国際医学誌への発表を行った[13].本稿は,表1における本邦唯一のブロックチェーンの医療応用に関する医学論文となっている.
本研究においては,被験者データの取得は上記の不眠障害に対するデジタル医療を通じてスマートフォン上で行った.本プログラムは公益財団法人神経研究所における倫理審査委員会の承認を経て,臨床試験登録システム:UMIN-CTRに登録された臨床試験(UMIN000023999)で使用されたものであり,被験者からのインフォームドコンセントを得た上で実施された[14].取得した医療データはJSON形式で保存された.ブロックチェーン基盤は当時v0.5であったHyperledger Fabric[15]を用いてブロックチェーンネットワークを構築した.ブロックチェーンネットワークの構築に関しては,Dockerコンテナを用いてMembership ServiceならびにValidating Peer 0-3からなるネットワークを組み,コンセンサスアルゴリズムについてはPBFT(Practical Byzantine Fault Tolelance)を採用した.
まずはじめに,ブロックチェーンネットワークが正常に稼働している条件下において,デジタル医療システムにより取得された医療データがブロックチェーンネットワーク上に登録されること,ならびにアップデートがされることを確認した.その後,Validating Peerのうち1つをダウンさせた状態でデータのアップデートが可能であることを確認した.本実証試験ではPBFTをコンセンサスアルゴリズムとして採用しており,4つのValidating Peerからなるネットワークを組んでいるため,1つのValidating Peerが障害時においてもコンセンサスが成立し,医療データのアップデートが問題なく行われた.その後,ダウンさせたValidating Peerを復帰させ,データのズレを確認後,データのアップデートを実施することにより,データのズレが修正されることを確認した.
これら結果より,デジタル医療データをブロックチェーン上で管理可能であること,ネットワーク障害に対する頑健性を有すること,さらにデータの改ざん等により生み出された齟齬に対して耐性を有することが確認された.
経済産業省は「平成29年度我が国におけるデータ駆動型社会にかかわる基盤整備(分散型システムに対応した技術・制度等にかかわる調査)」において,ブロックチェーンをはじめとした分散型システムを社会実装していくための調査を実施し,我々の上記取り組みは,医療ヘルスケア領域におけるユースケースとして取り上げられた[16].
4.デジタル医療の治験におけるブロックチェーン技術の実装
デジタル医療の治験におけるブロックチェーン技術の役割はデータ改ざん耐性の向上である.しかし,ブロックチェーン技術だけではデータ改ざんは防げない.なぜなら,データ書込前とデータ読込後にデータ改ざんに対する脆弱性が存在する場合,データが改ざんされるからである.そのため,データ改ざんを防ぐ治験データプラットフォームを実現するためにはブロックチェーン技術周辺システムを含めた設計が重要である.我々は,これまで述べてきたような実証試験を実施するとともに,これら課題解決のためにさらなる技術開発を行い,治験における実装を行っている.本項では,臨床試験・治験におけるデータの信頼性を担保するために,我々が開発・実装したブロックチェーンの周辺設計について解説する.
4.1 ブロックチェーンクライアントに関する設計
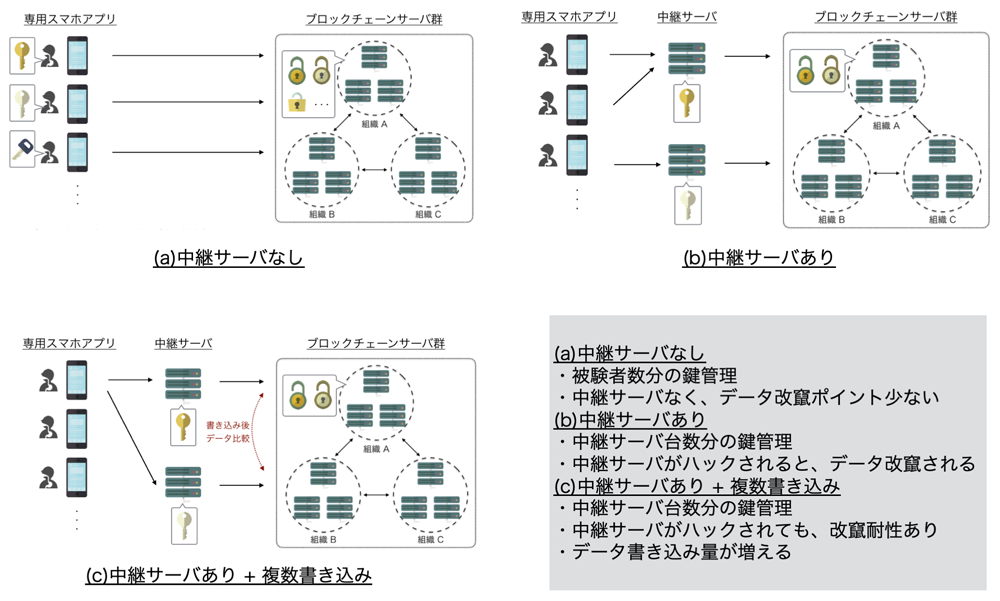
ブロックチェーンの書き込みを行うクライアントの決定は重要な設計である.被験者からのデータはまずスマートフォンに入力され,これをブロックチェーンに書き込む必要がある.考えられる設計パターンは,スマートフォンから直接書き込むパターンと中継サーバを介して書き込むパターンの2通りである.
スマートフォンから直接書き込むパターンは,中継点がないためデータ改ざんされにくい特性を持つ.しかし,ブロックチェーンサーバ群は,多くのスマートフォンからのデータ書き込みを受ける必要があり,IP制限などができず不特定多数からのアクセスをブロックチェーンサーバ群側で対応する必要があり,データ改ざんの危険性が高まる.また,スマートフォンの台数分の公開鍵を管理しなければならない点やブロックチェーンのクライアントSDKをスマートフォン用に整備する必要があり,開発運用コストが大きくかかる問題点もある.
一方,中継サーバを介して書き込むパターンは,その逆であり,スマートフォンの台数より少ない中継サーバに書き込みリクエストを集約することで,ブロックチェーンサーバ群側のネットワーク制限が可能となり,さらにはスマートフォン用のSDKや多数の公開鍵を管理する必要がなくなる.ただし,中継サーバが不正アクセスされたときにデータ改ざんの恐れがある問題点がある.
我々は,このトレードオフの問題を解決するために,中継サーバを介して書き込むパターンに新たな機構を加えた手法を本稿では提案する(図1).その機構とは,スマートフォン側がm台の中継サーバからn台をランダムにデータ送信時に都度選択して書き込みリクエストを送る機構である(m>n,nは3以上が望ましい.).この機構により,中継サーバが1台不正アクセスされただけでは,データ改ざんを隠密に実現することができず,データ改ざん耐性を向上させることができる.また,この機構のデメリットとしてデータ書き込み量がn倍になってしまう点があるが,治験の多くは,参加者が多くても1,000人程度,データ書き込み頻度が1日10回程度というボリュームしかないため,大きな問題とはならない.
4.2 ブロックチェーン書き込み中継サーバとスマートフォン間の認証
第4.1節のように中継サーバを利用した設計を採用した場合,中継サーバとスマートフォン間の認証の設計が重要となる.
最も簡単な方法は,共通認証サーバを準備することである.この方法では管理コストは低いが,共通認証サーバまたは中継サーバ1台の不正アクセスでなりすましが容易に可能になるため,データ改ざん耐性の観点から望ましくない.特に,中継サーバの管理者が,送られてきた認証トークンを利用して,書き込みデータを改ざんして他の中継サーバにリクエストを送信することでデータ改ざんが可能になるため危険である.
次に中継サーバごとに認証サーバを準備する方法がある.この方法は,1つの認証サーバの不正アクセスでデータ改ざんされる可能性はないが,中継サーバ台数と被験者数を掛け合わせた認証情報を管理する必要があり,管理コストが高くなる問題がある.また,万が一複数の認証サーバが不正アクセスされた場合,改ざんされたデータとオリジナルデータを切り分けることができない.そこで,本稿では別の手法として,クライアントハッシュチェーンを利用した手法を提案する(図2).
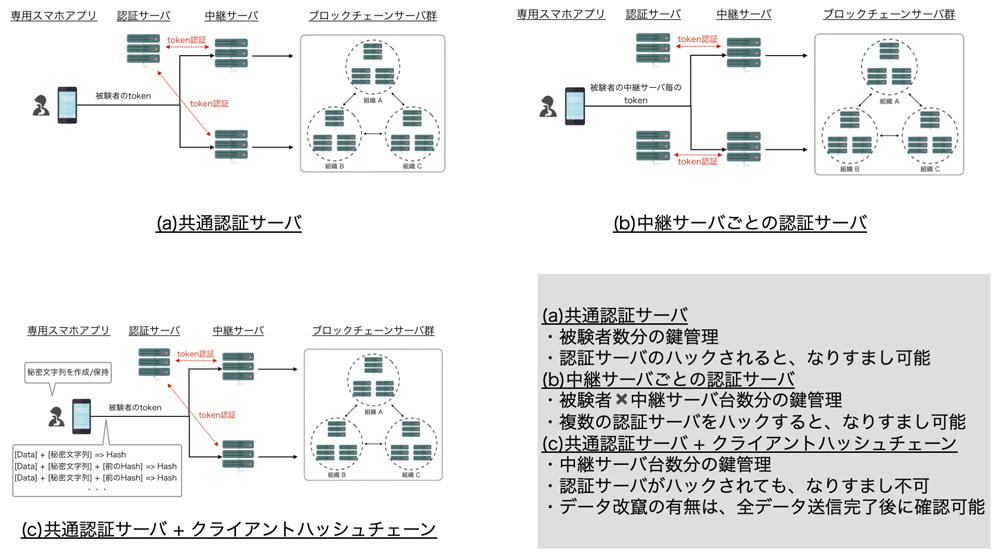
クライアントハッシュチェーンとは,被験者ごとにハッシュチェーンを作成し,そのデータを全体のブロックチェーンに書き込む手法である.まず,被験者は,初期設定として,スマートフォン内でランダムな秘密文字列を生成する.以降,この秘密文字列を入力に利用したハッシュチェーンを生成し,中継サーバに送信する.最後に,すべての治験データを送信完了後に,秘密文字列を送信する.クライアントと中継サーバの認証には,共通認証サーバを利用する.
このようなクライアントハッシュチェーンの仕組みによって,認証サーバや中継サーバの不正アクセスを行ってもデータ改ざんが不可能になる.なぜなら,秘密文字列がわからない限り,データの書き換えや追記が不可能だからである.また,秘密文字列が漏れて,かつ共通認証サーバが不正アクセスされた場合,なりすましによるデータの追記が可能にはなるが,被験者がスマートフォンからデータを送信している限り,データが途中から分岐していることを検知でき,被験者に確認する等の施策をとれば,正しいデータを判別することができる.唯一この手法の問題点としては,各被験者の最終データ送信完了時まで,データ改ざんの有無を発見できない点が挙げられる.仮想通貨などのState(状態)が重要な意味を持つデータにおいては,状態を改ざんされることによる問題(残高を改ざんして取引する等)が発生するが,治験においては完了時に改ざんのないデータを取り出せればよいため,問題にはならない.
以上のように,クライアントハッシュチェーンによってデータ改ざん耐性の向上と運用の低コスト化を実現している.本検証においては,3台の中継サーバを用意し,うち2台をランダムに選択してブロックチェーンネットワークへのデータ送信を行った.ブロックチェーンネットワークは3台のサーバで構成した.
4.3 データ読み込みにおける改ざん防止策
第4.2節までは,データ書き込み時における改ざん防止策を記述したが,データ読み込み時に意図的にデータを書き換えることでもデータ改ざんは可能である.これを防ぐ方法として,本稿では場合に応じて2つの方法を提案する.
1つは,チェーンコード(ブロックチェーン上に書くコード,Hyperleger Fabricにおける名称)上に治験結果の検証コードを事前にコミットし,治験終了時に自動で動作させることだ.この方法は,データに直接触れる機会がないため,検証コードが問題なければデータ改ざんが不可能となる.また,検証コードもブロックチェーン上に残るため,データ改ざんの発見がしやすい.さらに,データ改ざんの犯人が証拠とともに分かるため,改ざん者にとってのデータ改ざん実行リスクが大きくなる利点もある.ただし,治験中に予期せぬトラブルの発生や効果が見受けられるセグメントに偏りがある場合などは,事前に検証コードをコミットするケースが難しい場合もある.その場合には,もう1つの方法として,ブロックチェーンにアクセスできる複数の関係者で検証コードを共有し,結果が一致するといった方法を採用する.
ブロックチェーンからのデータ読み込み方法についても注意が必要である.多くのブロックチェーンでは,データの読み込み速度を早くするためにキャッシュサーバが設けられている.Hyperledger Fabricにおいても,LevelDBまたはCouchDBをキャッシュサーバ(StateDB)として利用している.キャッシュサーバ上のデータをブロックチェーン上のファイルデータと完全に同期することは難しく,その問題からキャッシュサーバ上のデータのみを書き換え,データ改ざんを実現される危険性が予想できる.そのため,データ読み込み時には各組織のキャッシュサーバのデータを読み込むのではなく,ファイルデータを読み込み,ハッシュチェーンの確認等を行うことが望ましい.そのため,本システムではキャッシュサーバを経由せず直接ファイルデータを読み込むようにしている.
5.ブロックチェーン技術の医療応用の展開
近年,ブロックチェーン技術はビットコインの出現等の高い話題性から注目を集めている.しかし,今日までのデータベースを始めとした進化の歴史を理解しないまま,過度な期待が寄せられている側面も強く,技術への深い理解にもとづく利用が重要だと考える.
特にパブリック型ブロックチェーンは中央集権からの脱却のための新たな革新技術として期待されているが,PoW(Proof of Work)をはじめとした経済合理性にもとづくコンセンサスアルゴリズムには未だに多くの問題があり,解決されていくのかは疑問である.一方で,コンソーシアム型ブロックチェーンは,技術的な新規性は低く注目度は低いが,データ改ざん耐性を向上させる分散管理台帳技術としては,現状でも有用である.ただし,データ改ざんはブロックチェーンのみでは防げず,治験プラットフォームの実現のためには,他の技術との併用が不可欠である.
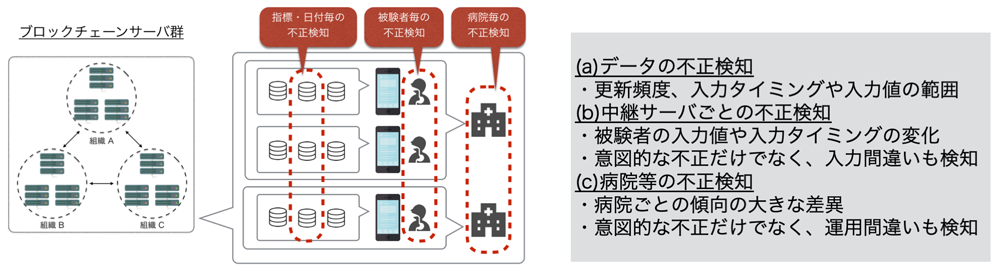
本稿で提案している治験プラットフォームにおいても,暗号化,通信制限,さらには機械学習による不正検知によってデータ改ざん耐性を向上させている.特に,図3に示す機械学習による不正検知は,データ改ざんを防ぐとともに,入力間違いや治験の運用方法の間違いも早急に修正できるようになり,有用である.これらの技術実装は医療ドメインに限らず,他領域においても利害が異なる当事者同士で記録内容の信頼性を担保する点で有用であり一般性を有する.例としてはさまざまな立場の当事者が参加するサプライチェーンの可視化や,データの確認作業を日常的に行っている場面での負担軽減が挙げられる.
本稿で提案した手法を元に,弊社では治療用アプリの治験において,ブロックチェーン技術を用いた治験プラットフォームを開発し,運用している.現状,大きな障害もなく,安定稼働している.ブロックチェーンの参加ユーザは現状は弊社のみだが,管理権限やネットワークを分離し,複数の会社や組織で持ち合う場合と同様のシステム構成になっている.また,ログ監査や自動ビルドなど高度な運用自動化を取り入れており,高いレベルでの運用を省力で実現している.さらには,治験プラットフォームは汎用化されており,さまざまな測定指標やテストが整備されており,治療アプリや新たな製薬の臨床試験または治験に即座に利用することができ,今後の医薬品の開発において利用することで,開発の高速化と開発費の抑制,さらには質の高いデータ担保による開発の高度化が期待できる.なお臨床試験においては,大規模な試験でも1,000人程度,細かなデータを取得するとしても1日10回程度のため,トランザクション量としても現時点のシステム規模で十分対応可能である.本検証においては,ユーザ数100〜120名,1ユーザ1日あたりのトランザクション数10±5件で運用した.
以上のように,コンソーシアム型ブロックチェーン技術は治験プラットフォームをはじめとした多くの医療システムにおいて,データ改ざん耐性の高い分散管理台帳技術としてほかの技術と組み合わせることで活用が期待できる.特にデータ改ざんの恐れがあり,人海戦術でデータ改ざんをしていないことを証明している分野においては,コストの削減とデータ改ざんリスクの低減の両立を実現し,医療の健全な発展に寄与できることを,本稿および弊社の実案件を通して示した.
謝辞 本稿の作成にご協力いただいた皆様に深謝いたします.
参考文献
- 1)Huber, M., et al. : How Should We Define Health?, BMJ. ; 343 : d4163. doi : 10. 1136/bmj.d4163, (July 2011).
- 2)http://www.jfmda.gr.jp/wp-content/uploads/2018/08/869bd41d8bc47b2e17508708c3a4e913.pdf
- 3)https://www.accessdata.fda.gov/cdrh_docs/pdf10/K100066.pdf
- 4)https://www.fda.gov/newsevents/newsroom/pressannouncements/ucm576087.htm
- 5)Torous, J. and Firth, J. : The Digital Placebo Effect : Mobile Mental Health Meets Clinical Psychiatry, Lancet Psychiatry.; 3 (2) :100-2. doi: 10.1016/S2215-0366 (15) 00565-9, (Feb. 2016).
- 6)厚生労働省:「平成29年度 医療費の動向」について, https://www.mhlw.go.jp/stf/houdou/0000177609.html
- 7)DiMasi, J.A., Grabowski, H.G. and Hansen, R.W. : Innovation in The Pharmaceutical Industry : New Estimates of R&D Costs. J Health Econ. ; 47 : 20-33. doi : 10.1016/j. jhealeco. (2016. 01. 012), (May 2016).
- 8)Scannell, J.W., Blanckley, A., Boldon, H. and Warrington, B. : Diagnosing The Decline in Pharmaceutical R&D Efficiency, Nat Rev Drug Discov. ; 11 (3) : 191-200. doi : 10.1038/nrd3681. (Mar. 2012).
- 9)2015 IMS Health : World Review, LifeCycle, Pharmaprojects, Thomson Innovation, EvaluatePharma.
- 10)Yui, Y. : Concerns about The Jikei Heart Study., Lancet, 379 (9824) , e48. doi: 10.1016/S0140-6736 (12) 60599-6. (Apr. 2012).
- 11)厚生労働省:臨床研究法について, https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000163417.html
- 12)(独)医薬品医療機器総合機構:ベンゾジアゼピン受容体作動薬の依存性について, https://www.pmda.go.jp/files/000217046.pdf
- 13)Ichikawa, D., Kashiyama, M. and Ueno, T. : Tamper-Resistant Mobile Health Using Blockchain Technology. JMIR Mhealth Uhealth.2017 Jul 26;5(7) : e111.doi: 10.2196/mhealth.7938.
- 14)https://upload.umin.ac.jp/cgi-open-bin/ctr/ctr_view.cgi?recptno=R000027629
- 15)https://www.hyperledger.org/projects/fabric
- 16)経済産業省:平成29年度我が国におけるデータ駆動型社会にかかわる基盤整備(分散型システムに対応した技術・制度等にかかわる調査), http://www.meti.go.jp/press/2018/07/20180723004/20180723004.html
1983年生.2009年上智大学院理工学研究科博士前期課程(機械工学)卒業.SIer研究員,Web系企業の分析者を経て,2017年よりサスメド(株)CTO.本会ビッグデータ研究グループ所属.2015年KDD CUP2位.『前処理大全』(技術評論社)執筆.
平野 友信(非会員)tomonobu.hirano@susmed.co.jp1984年生.前職まで大規模データ分析基盤を中心に携わり,2018年よりサスメド(株)にエンジニアとして在籍.ITインフラを中心としつつ,ブロックチェーンやWebアプリ開発まで幅広く担当.
奥村 恒介(非会員)kosuke.okumura@susmed.co.jpSIerにてデータ分析・機械学習分野を中心にさまざまなシステムの提案から設計・開発まで従事.2018年よりエンジニアとしてサスメド(株)に在籍.
樫山 真紀子(非会員)makiko.kashiyama@susmed.co.jpメーカー系SIerで製造業向けの基幹システム開発や,Linuxカーネル開発を経験.2016年よりエンジニアとしてサスメド(株)に在籍.
市川 太祐(非会員)daisuke.ichikawa@susmed.co.jp1981年生.2018年東京大学大学院医学系研究科社会医学専攻医学博士課程修了.医師,博士(医学).医療系データ分析企業を経て2016年よりサスメド(株) .訳書に「R言語徹底解説」(共立出版)等.
上野 太郎(非会員)taro.ueno@susmed.co.jp1980年生.医師,博士(医学).臨床医としての診療のほか,日本学術振興会特別研究員(DC1, PD),主席研究員としてネットワーク理論の医療応用・神経科学・分子生物学の研究を実施.井上研究奨励賞受賞.医療を持続可能にするためのシステム構築に関心のある仲間を募集中です.
採録決定:2019年4月26日
編集担当:中條 拓伯(東京農工大学)