生体信号ビッグデータ化プロジェクトALLSTAR ─オープンデータ化の意義と課題─
1.はじめに
ホルター心電図は,医療現場で広く利用されている臨床検査法であり,日常生活中の2から3チャンネルの心電図を100~500Hz/channelで24時間連続記録する.ホルター心電図検査では,1回の検査で約10万心拍/チャンネルの心電図波形と心拍動間隔(R-R間隔)の時系列データが得られる(図1)[1].
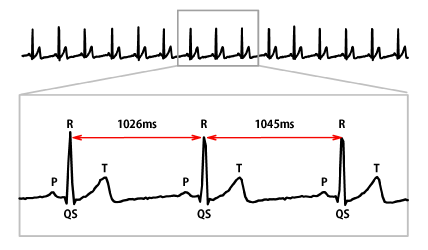
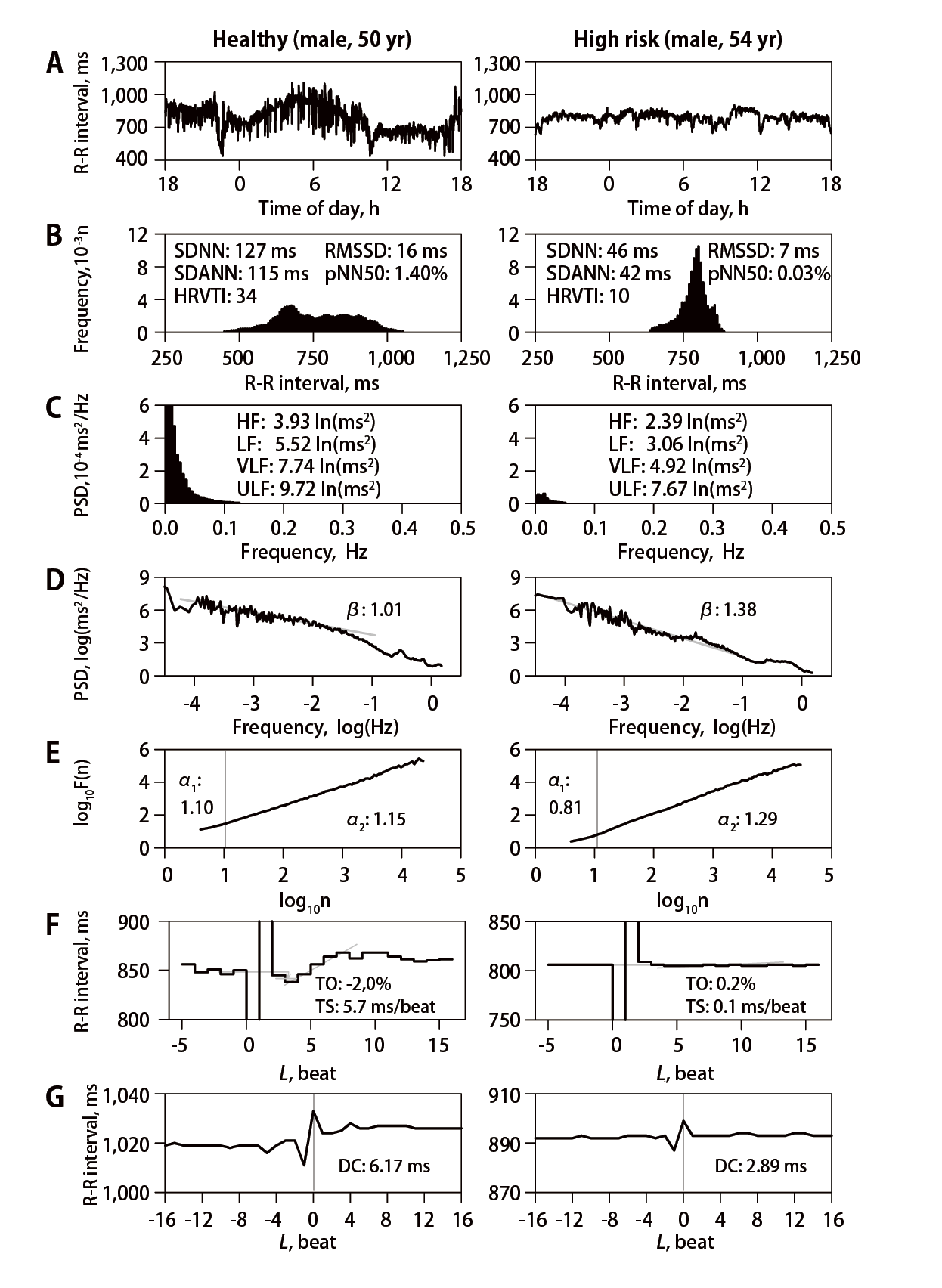
PSD = power spectral density, TO = turbulence onset, TS = turbulence slope.
ホルター心電図は,自由行動下の生体信号の長時間連続モニタとして,世界的に最も普及した方法で,日本だけでも推定で年間に延べ120万人分の24時間データが記録されている.このような,臨床検査としての品質が担保されたデータが,世界的な規模で日々記録されている状況は人類史的にも貴重な機会であり,この情報をデータベース化することで,地球環境や災害,社会事象などが生体に与える影響についての情報が,経時的に抽出できる可能性がある.
しかし,ホルター心電図データに対しては,その情報をビッグデータとしてデータベース化する試みや,ほかのデータベースと連携させる試みが,これまでほとんど行われてこなかった.その主な理由は,ほとんどのホルター心電図データが,個々の医療機関に個別に保管されているためである.しかし,ホルター心電図の特性を考えると,ビッグデータとしてのデータベースの構築とオープンデータ化はその真のポテンシャルを引き出すための重要なステップになることが期待される.
このような背景から,著者らは,2010年にAllostatic State Mapping by Ambulatory ECG Repository(ALLSTAR)プロジェクト[9]を発足させた.本プロジェクトでは,日本全国で記録されるホルター心電図の約5%にあたる年間約6万件のホルター心電図データの収集とビッグデータ化を進めており,現在,2007年〜2014年分の約30万件が登録されている.なお,ビッグデータという用語をここで用いる理由は,データの測定精度を考慮した対象数が膨大で日々拡大し続けていることと,個々のデータに含まれるサンプル数とその複雑さ(1例あたり約10万拍の心拍時系列データ)のために,通常のデータベースの処理方法では,十分な利活用が困難なことに基づいている.
本稿では,当プロジェクトで得られた知見を基に,生体信号ビッグデータのオープンデータ化の意義と課題について報告する.本稿の構成は,まず第2章でALLSTARプロジェクトの発足から今日までの経緯,臨床データを扱うことの倫理的背景,ホルター心電図の記録法の技術的背景と生体信号としての特徴について述べ,第3章では著者らの当プロジェクトにおけるプラクティスとその成果を紹介する.そして,第4章ではこれまでの実践経験を基に,生体信号ビッグデータを有効活用する手段としてのオープンデータ化の意義と課題について述べる.
2.ALLSTARプロジェクト
2.1 プロジェクトの経緯
ALLSTARプロジェクトは,7大学9名の研究者[9]を中心に,ホルター心電図データの所有者である(株)スズケン(名古屋)の協力を得て,2010年に発足した.当プロジェクトの目的は,日本全国で記録されるホルター心電図データから,環境因子が健康や疾患に与える影響を評価する方法を確立し,ホルター心電図の医療における利用価値を高めるとともに,健康寿命の延伸を中心とする予測・予防医療の推進に貢献することである(図3).
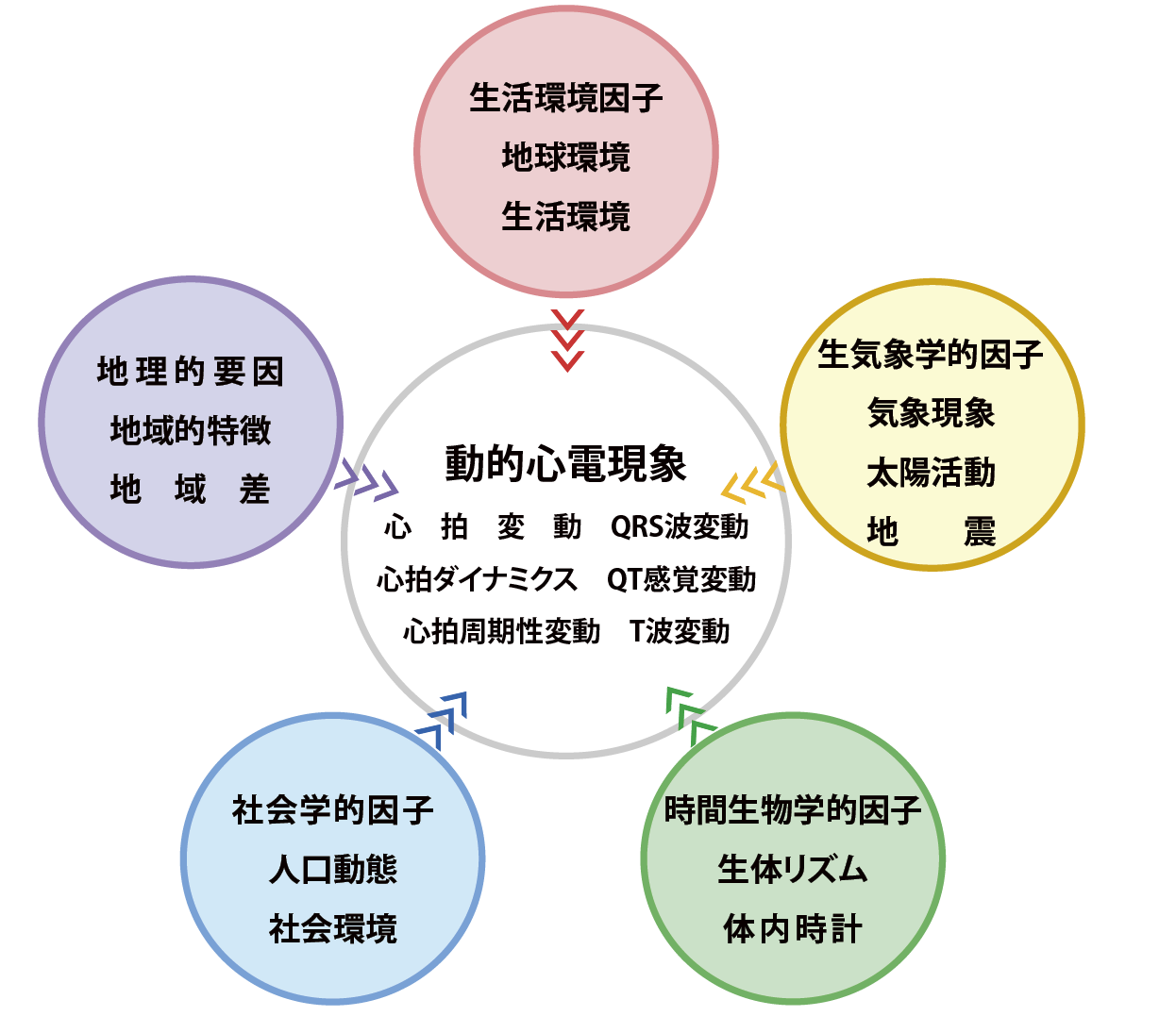
通常の臨床検査とは異なり,ホルター心電図検査は日常活動下で行われるために,そこから得られる検査指標には環境からの需要に応じた変動が含まれる.このような変動を適切に解釈するには,内部環境の指標の恒常性をもって健康を定義するHomeostasisの概念だけでは不十分で,環境からの要求に対する指標の適切な反応性をもって健康の定義とするAllostasis の概念(コラム)が必要である.
ALLSTARプロジェクトでは,その発足から2016年まで,年間3回のプロジェクト委員会を開催し,その中で,医療を通じて得た生体情報の研究使用の倫理性,データベースの構築とセキュリティの担保,データの解析と結果の解釈,オープンデータ化を含むデータの活用法などについて検討してきた.また,2017年には,日本生体医工学会の専門別研究会として「バイオメディカル・ビッグデータ研究会」が発足し,ALLSTARプロジェクトは,その中の活動テーマの一つとして情報発信を行うとともに,生体信号や生体指標のビッグデータの構築とオープンデータ化に共通する課題として,データベースの構築,管理,運用,倫理的問題を検討することとなった.
2.2 倫理的背景
ALLSTARプロジェクトは,名古屋市立大学大学院医学研究科および医学部附属病院における医学系研究倫理審査委員会によって承認された研究プロトコールに従って実施している(承認番号709,2012年).また,「人を対象とする医学系研究に関する倫理指針」(平成26年12月22日,文部科学省・厚生労働省告示第3号,平成29年2月28日一部改正)に基づいて,プロジェクトの目的とプロジェクトで利用する情報を,当プロジェクトのWebページ☆1およびホルター心電図データを所有する(株)スズケンのホルター心電図解析診断支援事業のWebページ☆2で公開しており,その中で検査対象者に自己の情報のプロジェクトにおける使用を拒否する機会を提供している.
2.3 ホルター心電図データ
ホルター心電図記録には超小型・軽量の心電計を用い,医療機関において電極とともに患者さんに装着する(図4).専用モニタで心電図の記録状態を確認した後,患者さんに,翌日同時刻以降の再来を指示し,心電計を装着したまま帰宅していただく.その間,自由行動下の心電図デジタル信号が24時間に渡って内蔵メモリに蓄積される.現在,診療目的で行われているホルター心電図検査では,安全性と実効性の観点から,データのリアルタイムの通信は行われていない.患者さんは24時間の記録が終了すると医療機関に心電計を返却し,ホルター心電図解析器を保有する医療機関では,心電計からデータを読み出して解析を行う.ホルター心電図解析器を保有しない医療機関は,心電図解析センターに解析を依頼するために,心電図データをSDカードに転送して解析センターに郵送する.センターでは送付されたデータを解析し,結果とそれに対するコメントを医療機関に送付納入する.
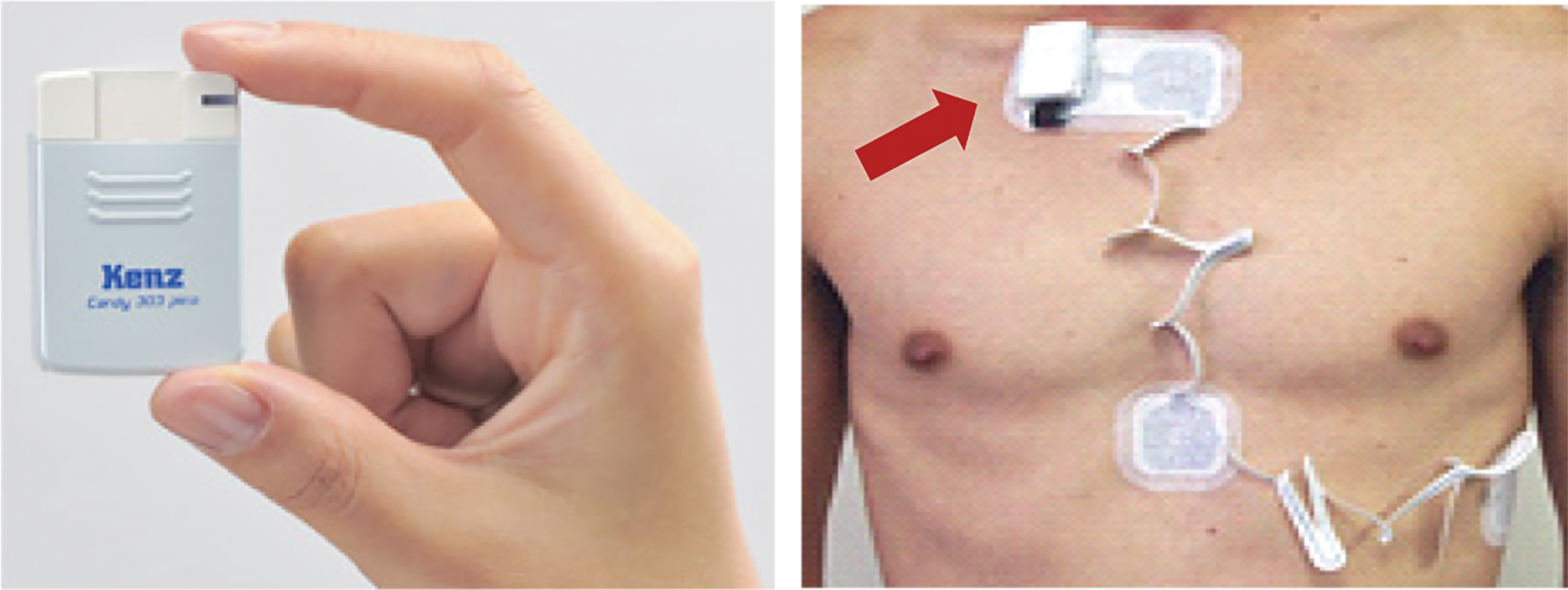
ALLSTARプロジェクトのデータベースの構築に使用されているデータは,(株)スズケンの札幌,東京,名古屋にある心電図解析センターが,医療機関から解析の依頼を受けた24時間ホルター心電図のうち,検査対象者によるプロジェクトでの使用を拒否する申し出のあったもの(実際にはほとんどない)を除いた,すべてのデータである.したがって,対象となるホルター心電図は,疾患の診断や除外,重症度判定,治療効果判定など,何らかの医療上の目的で記録されたものである.
具体的に述べると,ALLSTARプロジェクトのホルター心電図記録には,(株)スズケン社製のホルター心電計(Cardy 2, Cardy 2P, Cardy 203, Cardy 301, Cardy 302 Mini and Max, Cardy 303 pico and Cardy 303 pico+のいずれか)が使用されており,標本化頻度125Hzでデジタル化した心電図を保存している.データは,札幌,東京,名古屋のいずれかの心電図解析センターにあるホルター心電図解析器(Cardy Analyzer 05,(株)スズケン)によって,心拍の不整脈判定と拍動間隔の測定が行われている.
解析センターは,ALLSTARプロジェクトの目的のために,対象となるデータを匿名化し,年齢,性別,記録日時,記録場所(郵便番号)とともにデータベース保存している.(株)スズケンは,このようにして収集,保存されたデータの研究目的での使用についてのライセンスを,ALLSTARプロジェクト委員会に対して付与し,データをポータブルハードディスクを介してALLSTARプロジェクトの専用サーバに転送している.
2.4 データベースの構築
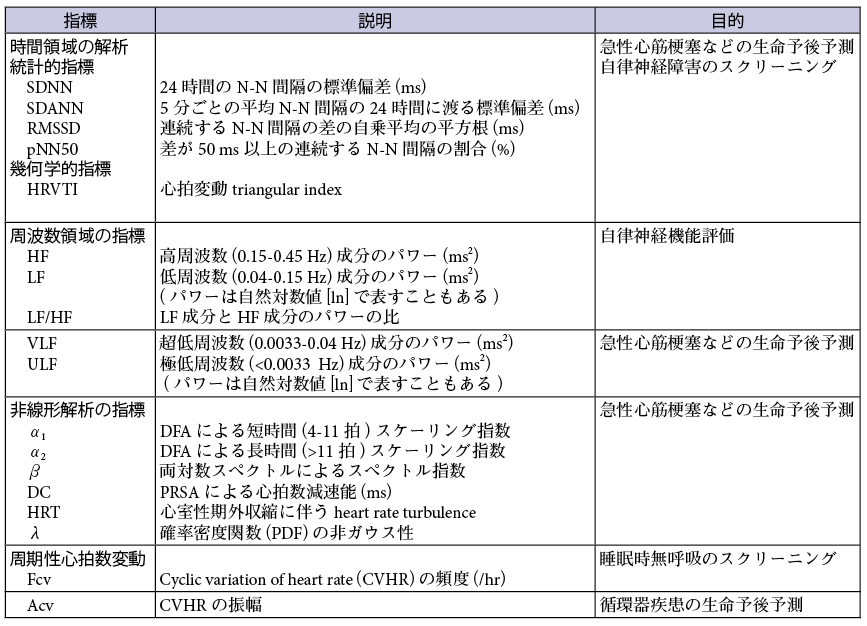
ALLSTARデータベースには,個々のホルター心電図データについて,年齢,性別,記録日時,記録場所の地理情報(郵便番号)とともに,24時間の全心拍について,次の情報を時系列データとして登録している.(1) 心拍の時間的位置,(2) 拍動間隔,(3) 心拍の調律の種類を示すラベル,(4) 虚血性変化の指標.これらの内,ホルター心電図データが有し,ウェアラブルセンサなどから得られる脈波信号データにはない重要なアドバンテージは,心拍の調律を示すラベルによって正常な洞調律の心拍と不整脈(心室性・心房性期外収縮,心房細動,心室頻拍など)とを正確に識別できることである.心拍変動解析では,洞調律のR-R間隔(N-N間隔)だけを用いて解析を行う必要があることから(表1),これはホルター心電図データの大きなメリットといえる.
なお,2010年11月以降は,3軸加速度センサを内蔵するホルター心電計の導入に伴い,記録中の体位と身体活動の程度を表すアクチグラフが24時間に渡って同時に記録されるようになった.3軸のアクチグラフのデータは,x(左右),y(前後),z(上下)軸それぞれ31.25 Hzでディジタル化され,心電図とともにセンターに送られ,データベースに登録されている.これによって,日常生活下のヒトの身体活動のデータについてもデータベース化が始まり,それとともに心拍変動などの心電図から得られる指標の変化が,どのような身体活動状況で生じたかをデータベース間の連携によって解析できるようになった.
3.プロジェクトの成果
3.1 登録されたデータとその分布
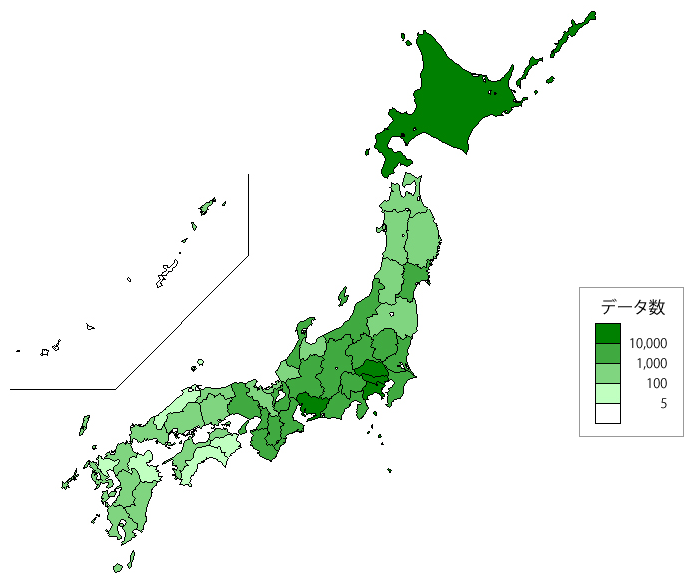
現在,データベースに登録されているのは,2007年11月から2014年3月の間に記録されたホルター心電図301,848件である(図5).これらのうち,46,114件は,アクチグラフのデータも登録されている.登録件数は地域ごとに異なるが,ほぼ全国からデータが収集されている(図6).年齢は0歳から100歳以上に渡り,性別では,男性が140,144件(median [IQR:interqualtile range],68[56-77]歳),女性が161,704件(70 [58-79] 歳)である.
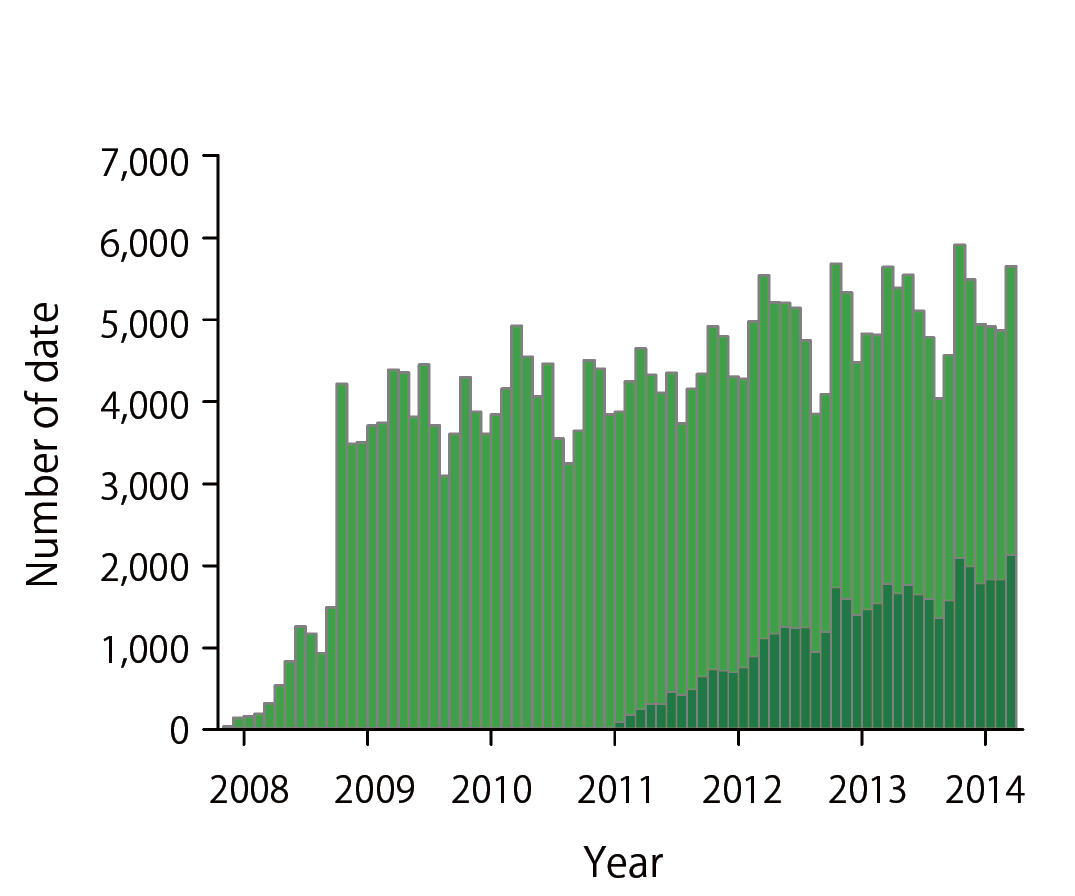
濃い部分はアクチグラフのデータが共に登録されている件数を表す.
3.2 ほかのデータベースとの連携
すでに述べたように,ALLSTARプロジェクトは,日本全国で記録されるホルター心電図データを基盤に,環境因子が健康や疾患に与える影響を評価するという方法の確立と,健康寿命の延伸を中心とする予測・予防医療の推進への貢献を目的としている.ALLSTARプロジェクトでは,これらを実現するために心電図データベースと,他のさまざまなデータベースとの連携による分析を行っている.
環境が心拍変動に与える影響の解析としてこれまでに試みたのは,気象庁の気象データベース,気象庁地磁気観測所の地磁気デ-タベース,国立天文台の月と地球の地心距離のデータベースなどとの関連である.特に,地球環境の変化が生態系に与える影響が懸念される中で,気温,気圧,湿度,日照時間が実環境において生体(ヒト)に与える影響を実測データから解析する意義は大きいかもしれない.
ALLSTARデータベースには,ホルター心電図が記録された場所の郵便番号と記録日時が含まれる.したがって,測定地点の測定時の気象データとの連携が可能と考えられたが,この作業は容易ではなかった.それは,郵便番号が示す測定地点と,その場所に最も近く気象データベースを有する地上気象観測点(気象台,測候所,観測所)との間の対応が不明であったためである.全国に地上気象観測点は全国に157カ所あり,各県に2~22カ所あるが,地域によってはその県の観測点よりも隣県の観測点の方が近い例があった.そこで,日本全国の郵便番号について,その地点に最も近い観測点を地図上の実測で特定し,郵便番号と直近観測点のID番号との対応表を作成した.この表によって,はじめて個々のホルター心電図データを,その記録地点の記録日の過去の気象データと連携させることができるようになった.
また,24時間のホルター心電図データは2日間にまたがって記録されるため,最高気温や最低気温と心電図データとの対応は,それぞれの発生する時刻を考慮して2日間のどちらの気象データと対応させるかをプログラムする必要があった.さらに,気象が生体に与える影響の分析では,同じ観測値であってもその影響は,地域の住環境や季節によって異なる.現在,これらの要因を考慮して分析を進めているところである.
一方,ALLSATARデータベースと健康指標のデータベースとを連携させた研究として,心拍変動の地域差と,健康寿命の地域差との関連を分析した[12].現在の日本人では,健康上の理由で他人の力を借りることなく生きられる期間である健康寿命と,生きていられる期間である平均寿命との間に,男性で平均9.02年,女性で平均12.40年のギャップがある[13].高齢人口が増加する中で,このギャップは社会にとって大きな負担となることから,健康寿命の延伸は健康政策における喫緊の課題であり,そのための効果的な方策が求められている.この観点から,健康寿命に見られる地域差は,有用な対策を探索する手がかりとなるかもしれない.2013年の厚生労働省のレポートによると,都道府県別の健康寿命には地域間で3年弱の差がある(図7).そこで,ALLSTARビッグデータを用いて,健康寿命の地域差と,心拍変動指標の地域差との関係を調べた.
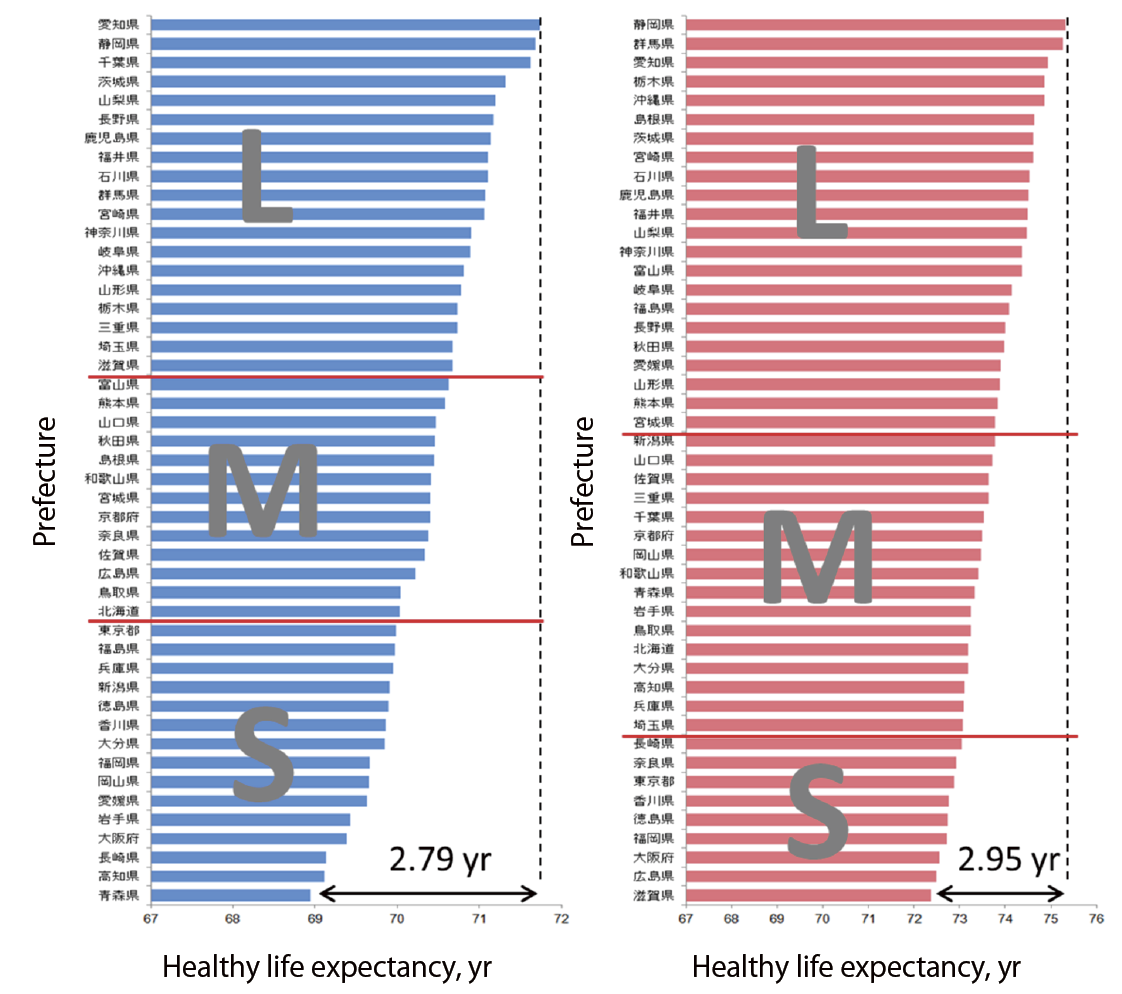
厚生労働科学研究費補助金「健康寿命における将来予測と生活習慣病対策の費用対効果に関する研究」(2013年)より (文献[12]の図を改変)
その結果,年齢の影響を調整すると,都道府県別の健康寿命と心拍変動(24時間の洞調律拍動間隔の標準偏差,SDNN)の間には,男女とも,正の関連があることが分かった.そこで,男女それぞれにおいて,健康寿命の長さによって都道府県を人口の合計ができるだけ等しくなるように3グループに分け(図7),心拍変動指標を3グループに含まれる県別に集計し,年齢の影響を調整して比較した.その結果,男女とも,SDNNは,都道府県グループの健康寿命の長さの順で大きくなった(図8上段).一方,都道府県を平均寿命のランキングによって3グループに分けた場合には,男女とも平均寿命の長さとSDNNの大きさとの間に有意な関連が見られなかった(図8下段).
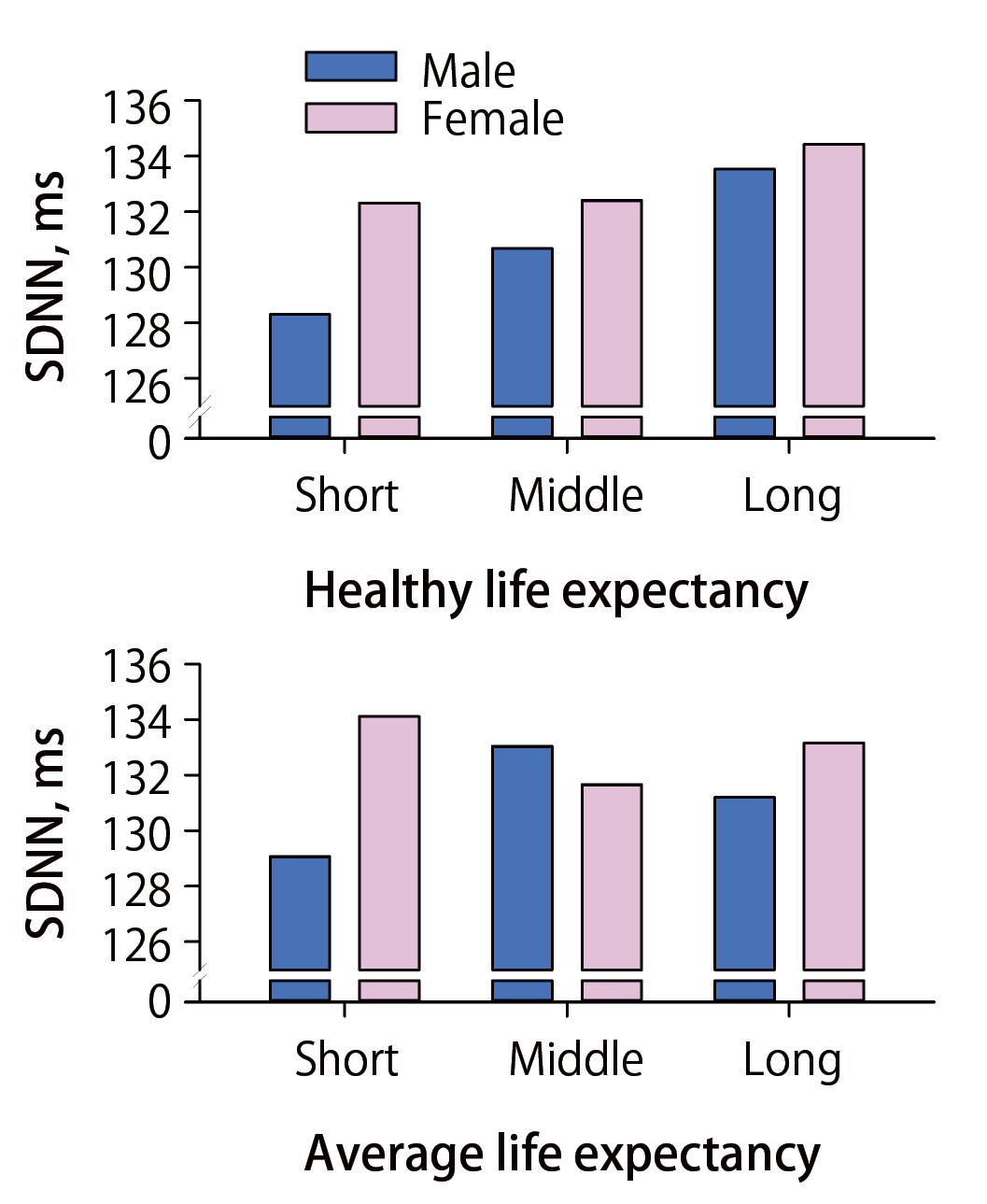
Average life expectancy=平均寿命,healthy life expectancy=健康寿命,SDNN=24時間の洞調律心拍動間隔の標準偏差(文献[6]の図を改変)
これらの結果は,心拍変動が,平均寿命よりも,健康寿命の長さに関連する生物学的特性を反映している可能性を示唆する.平均寿命を短縮する因子は死因であり,三大死因として知られている悪性腫瘍,心疾患,脳血管障害の寄与が大きい.一方,健康寿命の短縮には,認知症,フレイル(加齢による衰弱),脳血管障害の寄与が大きい[13].したがって,健康寿命を延伸するためには,認知機能および身体機能の不活発化の予防が必要で,それに適した指標のセルフモニタリングによる早期発見が必要かもしれない.
24時間心拍変動のSDNNの低下は,心筋梗塞後の死亡率の予測因子であることが知られているが[6],[14],少なくとも精神的,身体的活動時には心拍変動が減少する[2],[3].したがって,SDNNと認知機能および身体機能の不活発化との関係は単純ではないが,本研究の知見は健康寿命延伸のためのモニタリング指標についての有用な洞察を与えるものと考える.
4.オープンデータ化の意義と課題
4.1 オープンデータ化の意義
ALLSTARデータベースの強みは,世界的に最も広く普及し,かつ高い品質が担保された日常活動下の生体信号である24時間ホルター心電図をデータベース化したことである.これよって,ホルター心電図情報に含まれる膨大な情報の中から未知の有用な情報を発掘したり,既知の情報の新しい価値を発見したりする機会が増大することが期待される.また,さまざまな環境因子の生体作用を,その実環境に暮らす人たちの心電図情報を通じて分析するという新しい手段が得られる.
ALLSTARプロジェクトのデータ解析結果の多くは公表の準備中であるが,第3章で紹介した研究では,心拍変動の既知の指標であるSDNNと健康寿命との関連や,心拍変動と健康寿命の間の地理的関連性などがはじめて明らかになった.今後,表1に示したさまざまな心拍変動指標について,生体リズム,食事・運動・睡眠などの時間生物学的および行動科学的因子の影響,気象,地磁気,太陽活動などの生気象学的因子の影響,人口動態,大気汚染,地域性などの地理的および社会的因子の影響などの解析が予定されているが,オープンデータ化が実現すれば,さらに多様な視点や発想による解析の展開が期待できる.
一方,ALLSTARデータベースの現時点での弱みは,データベースが,医療の目的で収集されたデータで構成されていることである.分析結果の解釈においては,対象者の疾患やそれに対する治療の影響を考慮する必要がある.ただし,検査対象者からプロジェクトにおけるデータの使用が拒絶される例はほとんどないので,ALLSTARデータベースを日本でホルター心電図検査を受ける対象全体を代表するサンプルとみなすことには妥当性がある.いずれにしても,この弱点を補強することはALLSTARデータベースの重要な課題である.
そのための方策としてオープンデータ化は有用かもしれない.医療の目的で得られたデータのみを対象としている現在のALLSTARプロジェクトのデータ収集システムでは,健常者のホルター心電図データの効率的な収集は困難である.しかし,ALLSTARデータベースをオープンデータ化した場合には,それを研究に活用したいと考える研究者の中に,自分自身が数十例あるいはそれ以上のサイズの健常者のホルター心電図データを有している場合がかなりあるものと期待される.ALLSTARデータベースに健常者のデータが不足している状態は,そのような研究者にとっても共通の課題となることから,この課題の解決が利用者である研究者の間で共有されることになる.後で述べるように研究データの提供者の権利を保護するための匿名化を含めた倫理的課題の解決は必須であるが,学会等にも協力を呼びかけ,各研究者が有する健常者データとその属性の登録システムを整備することで,ALLSTARデータベースと併存する形で,健常者のホルター心電図のオープンデータベースが比較的短期間に構築される可能性がある.このシステムが実現すれば,健常集団のデータベースとALLSTARデータベースのそれぞれの価値が,相補的かつ相乗的に高まるという好循環が生ずることが期待できる.
4.2 オープンデータ化への課題
これまで述べてきたように,24時間ホルター心電図記録には多くの情報が含まれ,かつ世界中で日々データが蓄積されている.この状況を考えると,それらの情報全体を活用する技術の開発には,膨大な人的・時間的および計算資源が必要であり,オープンデータ化はその解決のための有望な手段となり得る.また,その結果として,データベースの透明性と信頼性の向上,プロジェクトに対する学会や医師会の参加,官民協働の推進,経済や行政の効率化など多くのメリットも期待できる.一方,ホルター心電図データのオープンデータ化には同時に多くの課題もある.以下,ALLSTARプロジェクト委員会において検討を重ねる中で認識された課題について述べる.
まず,最大の課題は医療の目的で収集されたデータのオープンデータ化による二次利用の倫理性と,データを所有している企業(本プロジェクトでは(株)スズケン)が受けるかもしれない社会的批判や風評被害のリスクのマネージメントである.医療情報の研究活用に関する倫理性に関しては「人を対象とする医学系研究に関する倫理指針」(平成26年12月22日,文部科学省・厚生労働省告示第3号,平成29年2月28日一部改正)に基づいて,研究機関の倫理審査委員会の承認を受けた研究計画書に従って実施することで担保されるが,オープンデータ化する場合には,同倫理指針の目的および方針にある「社会的及び学術的な意義を有する研究の実施」という要件を担保する手段が用意されていない.これに対応するには,医療情報の二次利用のためのオープンデータ化というさらに広い枠組みが必要である.また現時点では,医療情報の公益利用についての十分な社会的コンセンサスが得られているとはいえない.したがって,医療機関から分析の依頼を受け,データを所有している企業が,それをオープンデータ化したときには,それに対する社会的批判や風評被害を受ける可能性を排除できない.
次に,オープンデータ化のためには,データの匿名化技術の利用によるプライバシー保護の徹底が前提となる.ALLSTARデータベースの個々のデータは,年齢,性別のほかに,秒単位の測定日時および測定地点の郵便番号と結びつけられている.現在のデータ数から見ると,このままオープンデータ化するには粒度が細かすぎて,十分な匿名性が保てない可能性がある.また,データベースを他の,特に複数のデータベースと連携させた場合には,匿名性に関するリスクが急速に高まる可能性がある.さらに,ホルター心電図データはR-R間隔だけでも10万拍分の時系列データであることからまったく同じデータが存在する確率はほとんどなく,元のデータを持っている人はそのデータがオープンデータ化したデータベースに含まれているかどうかを確かめることができる.オープンデータ化のためには,これらの課題に対応した匿名化技術の準備が必要である.
オープンデータ化による十分なメリットを得るためには,二次利用のしやすさを考慮したデータ形式も重要な検討事項である.すでに述べたようにホルター心電図データでは個々の心拍に対して,その調律についてのデータが付随しており,心拍変動解析においては必須の情報となる.また,心拍変動解析には標準化されたアルゴリズムを用いる必要があるため,基本的な心拍変動指標については,適切なアルゴリズムで計算した結果を個々のデータに付随させる形で,オープンデータに加えることも考えられる.オープンデータ化のためには,ホルター心電図データの特徴や可能性を考慮したデータ形式を検討しておく必要がある.
ホルター心電図データベースのオープンデータ化には多くの課題がある.特に倫理的な問題や社会的なコンセンサスの形成は,ALLSTARデータベースだけを対象とする議論や方策では解決が困難で,他の生体情報データベースにも共通する課題としての解決が必要と考える.この議論の幅を広げ,より多くの見識を得るために,日本生体工学会において2017年に発足した専門別研究会「バイオメディカル・ビッグデータ研究会」では,生体情報ビッグデータのオープンデータ化における課題を中心テーマの一つとして検討して行く予定である。また,ALLSTARプロジェクト委員会では,この現状の中で少しでも多くの研究者がALLSTARデータベースを活用できるようにする方策として,メンバーとの共同研究の形の研究計画の申請を受け付け,そこで承認されたものについてはデータの研究利用を認めるというシステムの構築を検討している.
5.おわりに
自由行動下のヒトの生体信号の長時間連続記録として,貴重な情報資源と考えられる24時間ホルター心電図のビッグデータ化プロジェクトについて紹介し,実践を通じて得られた知見と課題について述べた.生体信号ビッグデータのオープンデータ化には大きなメリットがある.しかし,その実現のためには解決すべき課題があり,そのための議論に本稿が資することができれば幸甚である.
謝辞 ALLSTARプロジェクトは,公益財団法人科学技術交流財団(知の拠点あいち重点研究プロジェクト,超早期診断技術開発プロジェクト,P3-G1-S1-2b)および独立行政法人日本学術振興会(科学研究費助成 ©,25461062)による支援を受けた.ここに深く感謝申し上げる.
参考文献
- 1)Malik, M., Camm, A. J. ed.:Dynamic Electrocardiography, New York:Wiley-Blackwell (2004).
- 2)Camm, A. J., Malik, M., Bigger, J. T. Jr., Breithardt, G., Cerutti, S. and Cohen, R. J., et al.:Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. Heart Rate Variability:Standards of Measurement, Physiological Interpretation and Clinical Use, Circulation, 93, pp.1043-1065 (1996).
- 3)Hayano, J.:Introduction to Heart Rate Variability. In:Iwase, S., Hayano, J. and Orimo, S., eds:Clinical Assessment of the Autonomic Nervous System, Japan:Springer, pp.109-127 (2016).
- 4)Watanabe, E., Kiyono, K., Yamamoto, Y., and Hayano, J.:Heart Rate Variability and Cardiac Diseases. In:Iwase, S., Hayano, J., and Orimo, S., eds:Clinical Assessment of the Autonomic Nervous System, Japan:Springer, pp.163-178 (2016).
- 5)Schmidt, G., Malik, M., Barthel, P., Schneider, R., Ulm, K. and Rolnitzky, L., et al.:Heart-rate Turbulence after Ventricular Premature Beats as a Predictor of Mortality after Acute Myocardial Infarction, Lancet, 353, pp.1390-1396 (1999).
- 6)Bauer, A., Kantelhardt, J.W., Barthel, P., Schneider, R., Makikallio, T. and Ulm, K., et al.:Deceleration Capacity of Heart Rate as a Predictor of Mortality after Myocardial Infarction:Cohort Study. Lancet, 367, pp.1674-1681 (2006).
- 7)Kiyono, K., Hayano, J., Watanabe, E., Struzik, ZR. and Yamamoto, Y.:Non-Gaussian Heart Rate as an Independent Predictor of Mortality in Patients with Chronic Heart Failure, Heart Rhythm, 5, pp.261-268 (2008).
- 8)Hayano, J., Yasuma, F., Watanabe, E., Carney, R. M., Stein, P. K. and Blumenthal, J. A., et al.:Blunted Cyclic Variation of Heart Rate Predicts Mortality Risk in Post-myocardial Infarction, End-stage Renal Disease, and Chronic Heart Failure Patients, Europace:European Pacing, Arrhythmias, and Cardiac Electrophysiology:Journal of the Working Groups on Cardiac Pacing, Arrhythmias, and Cardiac Cellular Electrophy Siology of the European Society of Cardiology (2016).
- 9)Allostatic State Mapping by Ambulatory ECG Repository (ALLSTAR) http://www.med.nagoya-cu.ac.jp/mededu.dir/allstar/index.html (April 21 2017 date last accessed).
- 10)Cannon, W. B.:The Wisdom of The Body, New York:W. W. Norton (1932).
- 11)Sterling, P. and, Eyer, J.:Allostasis:A New Paradigm to Explain Arousal Pathology. In:Fisher, S. and Reasin, J., eds.:Handbook of Life Stress, Cognition and Health. New York:John Wiley & Sons: pp.629-649 (1988).
- 12)Yuda, E., Furukawa, Y., Yoshida, Y. and Hayano, J.:investigators Ap.:Association between Regional Difference in Heart Rate Variability and Inter-prefecture Ranking of Healthy Life Expectancy:ALLSTAR Big Data Project in Japan Procedings of the 7th EAI International Conference on Big Data Technologies and Applications (BDTA 2016), Seoul, Korea (2016).
- 13)Progress of Each Goal in Healthy Japan 21 (2nd stage), The Ministry of Health, Welfare, and Labour. http://www.mhlw.go.jp/file/05-Shingikai-10601000-Daijinkanboukouseikagakuka-Kouseikagakuka/sinntyoku.pdf (April 23 2017 date last accessed).
- 14)Kleiger, R. E., Miller, J. P., Bigger, J. T. Jr., Moss., A. J.:The Multicenter Post-Infarction Research G.:Decreased Heart Rate Variability and its Association with Increased Mortality after Acute Myocardial Infarction, Am J Cardiol, 59, pp.256-262 (1987).
心療内科・循環器内科医師.医学博士.名古屋市立大学医学部1980年卒業.1981〜1983年九州大学精神身体医学講座.1990年米国Duke大学メディカルセンター行動医学研究所客員研究員.2007年より名古屋市立大学大学院医学研究科教授.日本生体医工学科会専門別研究会・バイオメディカル・ビッグデータ研究会代表.
古川 由己(非会員)furukawa.yuki@gmail.comp東京大学工学部社会基盤学科卒業.現在,名古屋市立大学医学部.ヘルスケアハッカソン代表として,異業種交流の場を企画運営.ALLSTARでは震災による心拍変動指標への影響解析に従事.臨床的根拠を踏まえた上で個々人の価値観を反映した意思決定を支援することに関心がある.趣味は合気道.
吉田 豊(非会員)yyoshida@med.nagoya-cu.ac.jp2008年3月愛知工業大学大学院修了.博士(経営情報科学).2011年4月知の拠点・あいち重点研究プロジェクト研究員.2016年より現職.生体情報工学,人間工学の研究に従事.電気学会,自律神経学会,生体医工学会各会員.
湯田 恵美(正会員)emi21@med.nagoya-cu.ac.jp東京都三鷹市出身.筑波大学大学院博士前期課程修了.2013〜2014年,サンタモニカ大学リサーチアシスタント.2015年より名古屋市立大学医学研究科NEDOプロジェクト研究員(現職).2017年より情報処理学会EIP研究会運営委員(現職).コンピュータサイエンス,知的財産,情報セキュリティに関する研究に従事.
採録決定:2017年8月22日
編集担当:西 直樹(NEC)